C
UANDO se humedece una semilla, ésta absorbe agua y se inician en ella las actividades metabólicas como la respiración y la síntesis de proteínas; después de cierto tiempo el embrión emerge de la semilla. En este momento se dice que la semilla ha germinado.Para que el proceso de germinación se lleve a cabo con éxito, es necesario que exista humedad, oxígeno y una temperatura adecuada. No obstante, es frecuente que aun cuando las semillas se encuentran bajo esas condiciones, no germinen. Esto se debe a que existe un impedimento o bloqueo en alguna parte del proceso de germinación que evita que se desarrollen los cambios necesarios en la semilla. Estos impedimentos desaparecen al proporcionar a la semilla un estímulo del medio ambiente, como sería la luz o la temperatura baja, o bien dejando que el tiempo transcurra para que se vayan produciendo ligeros cambios en la propia semilla. A esta incapacidad de germinar aun bajo condiciones adecuadas se le llama latencia.
Una vez que la semilla ha germinado, el crecimiento continúa y las reservas de los cotiledones o del endospermo son transportadas hasta las partes nuevas de la plántula, cuyas células están reproduciéndose y elongándose activamente. Este proceso, que continúa hasta que la plántula, comienza a absorber agua y nutrientes del suelo e inicia la actividad fotosintética convirtiéndose así en una planta joven, establecida e independiente, no se detiene, excepto por la muerte.
El primer paso para que se inicie la germinación es que la semilla entre en contacto con el agua. Ésta es fundamental para que la semilla se rehidrate y exista un medio acuoso donde los procesos enzimáticos puedan llevarse a cabo. La semilla requiere de una pequeña cantidad de agua para rehidratarse, generalmente no más de 2 a 3 veces su peso seco; sin embargo, la nueva plántula tiene requerimientos mayores para que sus raíces y hojas puedan seguir desarrollándose. Son dos los factores que deben tomarse en cuenta al analizar el proceso de absorción (llamado imbibición) de agua por parte de la semilla: 1) las relaciones de la semilla con el agua, y 2) la relación entre la semilla y el sustrato.
La cantidad de agua que absorbe y la velocidad con que lo hace están determinadas por procesos físicos de difusión y por las propiedades de los coloides. El agua tiene que atravesar una membrana permeable, la cual presenta una alta concentración de sustancias en uno de los lados. Las moléculas del solvente penetran a la sustancia que se está hinchando o imbibiendo, ocupando los espacios capilares e intermicelares del coloide. Esto produce una presión de imbibición, de fuerza considerable, la cual llega a alcanzar valores de cientos de atmósferas. Esta presión puede llevar al rompimiento de la testa durante la germinación. En las semillas, el principal componente que se imbibe de agua son las proteínas; también participan otros compuestos como los mucílagos y la celulosa.
La hidratación de una semilla se produce en tres fases. En la fase I se lleva a cabo la absorción inicial del agua (imbibición) y es consecuencia de las membranas celulares y de las fuerzas ejercidas por los contenidos; ocurre tanto si la semilla está viable como si no lo está, si está latente o no. Es independiente de la actividad metabólica de la semilla, aunque ésta se inicia rápidamente con la entrada del agua. La fase II corresponde a un periodo de rezago. Las semillas muertas y las latentes mantienen este nivel de hidratación. Para las semillas que no están latentes es un periodo de metabolismo activo que prepara la germinación; para las semillas latentes también es un periodo de metabolismo activo y para las muertas es un periodo de inercia. La fase III está asociada con la germinación y sólo la presentan las células viables, no latentes. Durante esta fase obviamente hay actividad metabólica, incluyendo el inicio de la movilización de las reservas almacenadas.
La superficie de la semilla que está en contacto con el suelo también afecta la capacidad de absorción de ésta. Mientras mayor es el contacto, más cantidad de agua puede ser absorbida. Por lo tanto, el tamaño y la estructura de la cubierta de la semilla son factores determinantes, al igual que la microtopografía del suelo. Desde la perspectiva de una semilla, la estructura del suelo es sumamente heterogénea. Está lleno de montículos, grietas, pendientes, etcétera, y éstos cambian con la textura del suelo. Así, no todas las posiciones de una semilla harán buen contacto con las partículas del suelo, ni tendrán acceso a suficiente humedad para germinar. La forma y tamaño de la semilla también afectará, como se puede apreciar en la figura VIII.4 (capítulo VIII). Se ha visto que conforme se incrementa el contacto de la semilla con el suelo, aumenta la velocidad con que ésta se hidrata y por tanto la germinación se lleva a cabo más rápidamente.
La imbibición de las semillas se determina también en función de su morfología. En algunas especies, la entrada principal de agua es por el micrópilo (zona donde la testa es más delgada), más que por toda la superficie de la testa (Vicia y Phaseolus). En algunas semillas de testa dura e impermeable, mientras no se perfore la testa el agua no puede penetrar y por lo tanto las semillas permanecen latentes. En algunas de las leguminosas es necesario remover una protuberancia que funciona como una especie de tapón, llamada estrofiolo (Melilotus alba, Crotalaria egyptica). Se ha visto que numerosos haces vasculares desembocan en este punto, por lo que una vez roto o removido el estrofiolo, es un canal de entrada importante de agua (Acacia spp., Albizzia lophantha).
Durante la germinación las células gastan energía. El requerimiento energético de las células vivas se mantiene generalmente por procesos de oxidación, en la presencia o ausencia de oxígeno (respiración y fermentación respectivamente). Comprenden un intercambio de gases, una liberación de bióxido de carbono en ambos casos y una entrada de oxígeno en el caso de la respiración. Por tanto, la germinación es afectada por la composición de los gases circundantes. La mayoría de las semillas germina en una atmósfera que contenga 20% de oxígeno y un bajo porcentaje de bióxido de carbono (0.03%). La mayoría de las semillas presentará valores menores de germinación si la tensión de oxígeno disminuye. En cambio, la mayoría de las semillas no germinará si aumenta mucho la tensión del bióxido de carbono.
Las semillas de diferentes especies germinan bajo diferentes rangos de temperatura, a excepción de temperaturas extremosas. La sensibilidad de las especies difiere y no necesariamente a una mayor temperatura corresponde un incremento en la germinación. El efecto de la temperatura sobre las semillas es muy variado. La germinación es un proceso complejo formado por varias etapas; un cambio en la temperatura afectará cada uno de estos pasos o etapas. Por tanto, el efecto general de la temperatura sobre la germinación es el reflejo de todo ese conjunto de resultantes.
El efecto de la temperatura sobre las semillas secas, sin imbibir, es muy diferente. En el primer caso, se ha comprobado que muchas especies, sobre todo las de testa dura, son capaces de soportar altas temperaturas durante periodos prolongados de tiempo. Por ejemplo, especies que viven en ambientes sujetos a fuegos frecuentes soportan muy bien estas altas temperaturas. Entre ellas están varias especies de Acacia de Australia, al igual que la leguminosa Albizzia lophantha. Rhus ovata, habitante del chaparral de California, alcanza sus porcentajes más altos de germinación (30-34%) después de 5-10 minutos a 100°C. Otro ejemplo son las especies de dunas costeras de zonas tropicales, donde la arena alcanza diariamente temperaturas entre los 50 y 60°C durante la época de secas. Las semillas que están sobre la superficie se ven sujetas a estas temperaturas durante varias semanas, por ejemplo la Chamaecrista chamaecristoides y la Acacia farnesiana, entre otras.
Las semillas de cada especie pueden germinar dentro de un rango de temperaturas; sin embargo existe un punto óptimo, arriba o por debajo del cual la germinación también se lleva a cabo pero más lentamente. Así, la temperatura óptima es aquella bajo la cual se obtiene el porcentaje más alto de germinación en el menor tiempo. Las temperaturas máximas y mínimas de germinación son las temperaturas más altas y más bajas en las cuales todavía se produce germinación (Figura IV.1(a)). En la gráfica, en el eje horizontal o de las x aparecen los días a lo largo de los cuales se observó la germinación y en el eje vertical o de las y se observa el porcentaje de germinación. La pendiente o inclinación de la curva nos da la velocidad de germinación. Ésta varía en función de la temperatura.
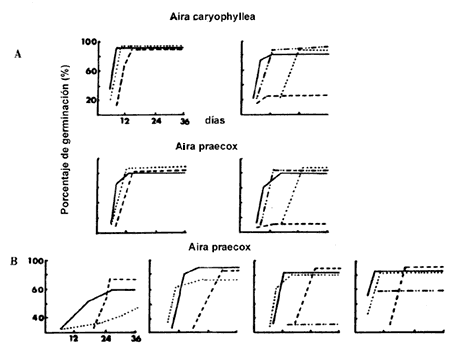
Figura IV.1. A) Gráficas de la germinación de especies anuales que colonizan las dunas costeras de Gran Bretaña. Las de la izquierda muestran la germinación con dos periodos alternantes de temperatura (5-15°C, 10-20°C y 15-25°C); las de la derecha, los resultados obtenidos con temperaturas constantes (5°C, 10°C 15°C y 25°C). En ambos casos se usaron semillas colectadas hacía 4 meses. B) Gráficas de la pérdida de sensibilidad a la temperatura conforme las semillas tienen mayor tiempo de haber sido colectadas. Muestran como las semillas de Aira praecox, con la edad, presentan respuesta a un rango más amplio de condiciones incrementando el porcentaje de germinación y la velocidad. Los resultados fueron obtenidos bajo temperatura constantes (5°C, 10°C, 15°C y 25°C) (modificado de Pemadasa y Lovell, 1975).
La temperatura y el rango en el cual las semillas germinan, está en función del origen de las semillas, de sus características genéticas y de su edad. A continuación se presentan algunos datos de temperaturas de germinación para varias especies:
Temperatura º C | |||
Especie | Mínima | Óptima | Máxima |
| Zea mays (maíz) | 8-10 | 32-35 | 40-44 |
| Triticum sativum(trigo) | 3-5 | 15-31 | 30-43 |
| Avena sativa(avena) | 3-5 | 25-31 | 30-40 |
| Nicotiana tabacum(tabaco) | 10 | 24 | 30 |
Muchas semillas no germinan a una temperatura específica constante, sino que requieren una alternancia periódica de temperaturas para que ocurra la germinación. Parece ser que lo fundamental es esta alternancia de temperaturas y no tanto las temperaturas específicas, siempre y cuando caigan dentro de un rango adecuado para la especie en particular. En estos casos, diariamente se mantiene a las semillas a cierta temperatura, por ejemplo la más alta, durante cierto número de horas, y luego se colocan a la temperatura más baja el resto del día. He aquí algunos ejemplos:
| Especie: Agrostis alba | ||||||
| Temperatura (°C): | 12-21 | 21-28 | 21-35 | 12 | 21 | 35 |
| % de germinación: | 69 | 95 | 95 | 49 | 53 | 79 |
| Especie: Amaranthus greggi | ||||||
| Temperatura (°C): | 20-25 | 20-32 | 20-40 | 15 | 25 | 35 |
| % de germinación: | 94 | 87 | 86 | 57 | 55 | 57 |
| Especie: Sporobolus virginicus | ||||||
| Temperatura (°C): | 20-25 | 20-32 | 20-40 | 15 | 25 | 35 |
| % de germinación: | 50 | 96 | 94 | 2 | 0 | 0 |
Estos datos muestran que existe un incremento en el porcentaje de germinación con la alternancia de temperaturas. En el caso de Sporobolus virginicus se ve que requiere un rango amplio de variación de temperatura, pues no germina a temperaturas constantes, y cuando la variación es de cinco grados, sólo germina la mitad de la población. En cambio, cuando la alternancia abarca doce grados o más, casi todas las semillas germinan.
Esta alternancia de temperaturas es muy parecida a la que ocurre en la naturaleza diariamente, pues existen diferencias entre el día y la noche; este rango varía según la estación del año, la latitud y también en función del microambiente (según esté más o menos sombreado).
La sensibilidad de las semillas a la alternancia de temperaturas frecuentemente se va perdiendo con la edad. Va dejando de ser un requisito indispensable, ya que lentamente muchas semillas empiezan a germinar aun a temperaturas constantes (Figura IV.1(b)). Lo harán en el momento en que haya suficiente humedad, cuando la temperatura caiga dentro del rango adecuado. Esta misma pérdida de sensibilidad con la edad se da con respecto a otros factores, como la luz. En condiciones naturales esto significa que si pasado un tiempo no se dan las condiciones óptimas de germinación que indican a la semilla la existencia de un medio ambiente adecuado para el establecimiento de la plántula (capítulos V y VI), finalmente la semilla germinará.
Existe una gran variedad de respuestas en la germinación de las semillas con respecto a la luz. Entre las plantas cultivadas se ha visto que no requieren luz para germinar, pues lo hacen de igual manera en la luz que en la oscuridad. En cambio, muchas semillas silvestres tienen comportamientos diferenciales con respecto a la luz. Existen aquellas que sólo germinan en la oscuridad, aquellas que sólo germinan bajo luz continua, otras que requieren de un periodo breve de iluminación para germinar y otras más que son indiferentes a la presencia de luz u oscuridad. Al igual que en el caso de las temperaturas alternantes, las semillas encuentran en la naturaleza ambientes lumínicos muy diversos: bajo la vegetación, en un hueco, bajo la hojarasca, bajo tierra, etcétera.
Ecológicamente la luz es un factor de gran importancia. Determina la posición en el suelo donde va a germinar una semilla; controla la germinación bajo el dosel de las ramas de los árboles, y al interactuar con la temperatura participa en el control estacional del rompimiento de la latencia (capítulo V).
Algunas semillas sólo requieren luz para germinar cuando están recién colectadas, mientras que en otras este efecto persiste hasta por un año y en otras más, se desarrolla durante el almacenamiento. Por lo tanto, es un factor en el cual la edad de la semilla también es determinante.
La sensibilidad de las semillas de muchas especies a la luz, aumenta en relación con el tiempo de imbibición. El almacenaje de semillas bajo condiciones de humedad relativa alta es suficiente para hacerlas sensibles a la luz.
Las primeras investigaciones que analizaron con detalle el efecto de la luz en la germinación se llevaron a cabo con semillas de lechuga. Demostraron que dentro del espectro de luz había tres regiones que afectaban la germinación y la latencia: a) el azul, alrededor de los 450 nm, b) el rojo, alrededor de los 650 nm y c) el rojo lejano, alrededor de los 750 nm (Figura IV.2). Se encontró que la luz roja rompe la latencia y promueve la germinación, mientras que la luz azul y la roja lejana inhiben la germinación. También se encontró que la alternancia de iluminaciones provoca una reversión de la estimulación y la inhibición de la germinación. La germinación de las semillas de lechuga es estimulada por la luz roja pero puede inhibirse si posteriormente se iluminan con luz infrarroja. Si más tarde se iluminan con luz roja se vuelve a inducir la germinación. La luz roja estimula la germinación y la luz infrarroja la inhibe. Se puede repetir esta alternancia y obtener esta respuesta numerosas veces. La naturaleza de la última iluminación será la que determine la respuesta germinativa.
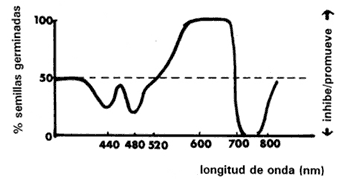
Figura IV.2. Efecto de varias longitudes de onda en el rompimiento de la latencia de semillas de lechuga. Éstas, que generalmente permanecían latentes en la oscuridad, fueron irradiadas con suficiente luz roja para obtener una germinación potencial de 50% en el lote experimental. Después fueron sometidas a luz de diferentes longitudes de onda y se pusieron a germinar en la oscuridad, contándose el número que germinó después de un día. Se puede ver claramente que la luz naranja-roja (600-700 nm) rompe la latencia y promueve la germinación, mientras que la luz infrarroja (720-780 nm) principalmente, pero también la azul (420- 500 nm), inhiben la germinación reimponiendo la latencia (tomado de Bewley y Black, 1982).
Este fenómeno responde al espectro de actividad del pigmento vegetal llamado fitocromo (F), el cual existe en dos formas interconvertibles. Este pigmento se comporta de la siguiente manera:
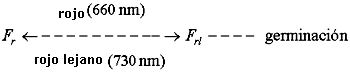
En la oscuridad, el pigmento no puede romper la latencia de las semillas. Cuando la semilla se pone bajo la luz, este pigmento absorbe la luz roja (por lo que se le llama Fr) y rápidamente se convierte en una forma que sí es activa en el rompimiento de la latencia (inicio de la germinación), pero que a su vez absorbe luz roja lejana (por tanto se le llamaFrl). La absorción de luz roja lejana por Frl hace que rápidamente se revierta a Fr; la latencia no se rompe y no hay germinación.
Igual que en otros muchos fenómenos en los que interviene la luz, el efecto depende tanto de la intensidad como de la duración de la iluminación. La respuesta germinativa —estimulación e inhibición— estará en función tanto de la intensidad de la luz como de su duración, o sea de la energía total de irradiación. Sin embargo, las transformaciones del fitocromo requieren muy poca energía e irradiaciones de unos cuantos segundos o minutos pueden ser suficientes para romper la latencia y germinar. Algunas otras requieren mucho más tiempo, dependiendo de las cubiertas de la testa que actúan como un filtro.
En la figura IV.3(a) se muestra el espectro de absorción del fitocromo. La forma Frpresenta el pico de absorción alrededor de los 660 nm. Una vez convertido a Frl el pico se corre hacia los 730 nm. Debido a la menor absorción de Frl se requieren mayores niveles de energía para revertirlo que los que se necesitan para convertir a la forma Fr. Por lo tanto, para lograr la fotorreversión en una semilla se requieren mayores niveles de energía de luz roja lejana que de luz roja. Un hecho importante es que las dos curvas se sobreponen (zona sombreada). Esto significa que a cierta longitud de onda que es absorbida tanto por el Fr como por el Frl, en un conjunto de moléculas de fitocromo se producen transformaciones fotoquímicas simultáneamente en ambas direcciones. Aunque éstas se producen a diferentes velocidades y se establece un equilibrio representado por la proporción de Frl / Ftotal, llamado f(de la letra griega phi). Por ejemplo, cuando el Fr se irradia con luz de 660 nm, se forma Frl; pero este Frl también absorbe esa longitud de onda (660 nm), así que algo se revierte a Fr hasta producir cierto equilibrio, que en este ejemplo es la existencia de 80% de Frl (Figura IV.3(b)). Por lo tanto, no puede haber una conversión total de todo el Fr a Frl, aun bajo una longitud de onda en la cual el Fr absorbe a su máximo.
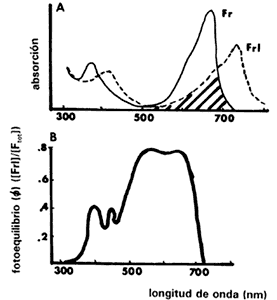
Figura IV.3. A) Espectro de absorción del fitocromo en sus formas Fr y Frl. Puede verse que hay una sobreposición entre ambos espectros. La forma Fr absorbe luz roja y se convierte a una forma activa que rompe la latencia y a su vez absorbe luz roja lejana pasando a la forma Frl. B) Fotoequilibrio del fitocromo resultado de la proporción total de Frl / Fr. Es producto de las transformaciones fitoquímicas que se dan, ya que Fr y Frl absorben una cierta longitud de onda, ocurriendo transformaciones en ambos sentidos debido al sobrelapamiento en las curvas de absorción de la figura (A) (tomado de Bewley y Black, 1982).
Este equilibrio es el que permite a la semilla detectar la calidad de la luz del medio ambiente en que se encuentra, particularmente con respecto a la proporción rojo/rojo lejano. De esta manera la germinación de la semilla se restringe a aquellos ambientes que poseen cierta calidad de luz. Así, semillas que requieren un valor relativamente alto de fno germinarán cuando la luz haya sido filtrada por las hojas verdes del dosel, pues es una luz rica en longitudes de onda rojo lejano, y la germinación se producirá en ambientes más abiertos, más adecuados para el crecimiento de la plántula.
Finalmente, es importante mencionar que diversos factores tanto internos como externos modifican la respuesta de las semillas a la luz. La presión osmótica, la presencia de promotores o inhibidores del crecimiento, la tensión de O2, entre otros factores, pueden cambiar la duración e intensidad de luz requerida para obtener cierta respuesta. Se ha visto que para algunas semillas como la Arabidopsis thaliana, el espectro de radiación al que ha sido sometida la planta progenitora durante la formación de las semillas afecta la respuesta de éstas a la luz.
Concluyendo, todos los factores internos y externos que afectan la germinación interactúan de alguna manera. Por lo tanto, en muchas ocasiones la latencia de una especie puede romperse por la acción de diversos factores y no sólo por uno. Por ejemplo, la latencia de la Betula pubescens puede romperse por el efecto de la luz o de la baja temperatura y en la Nicotiana tabacum por la luz o por la alternancia de temperaturas. Esta diversidad de posibilidades hace que la semilla tenga más oportunidades de germinar en un ambiente heterogéneo y cambiante.
Se dice que una semilla ha germinado cuando aparecen las primeras señales de crecimiento; en primer lugar emerge la radícula y después aparece el hipocótilo o plúmula. La extensión del eje embrionario, o sea todo el embrión excepto los cotiledones, se debe principalmente a la imbibición del agua y al inicio de acumulación de nuevo tejido. Esta primera actividad de crecimiento se da aun antes de que emerja la radícula; es resultado sobre todo de la elongación de las células y a veces también se produce la división celular al mismo tiempo. Durante la imbibición se inicia un metabolismo muy activo (respiración y síntesis de proteínas) que está asociado con la hidratación de las enzimas. Todo este proceso comprende cambios químicos muy complejos. Son de tres tipos básicamente: el rompimiento o degradación de ciertos compuestos presentes en las semillas, el transporte de materiales de una parte de la semilla a otra, principalmente del endospermo al embrión o de los cotiledones a las partes en crecimiento, y por últimonb la síntesis de nuevos materiales a partir de los que fueron degradados.
Es importante resaltar en este momento la síntesis de proteínas como uno de los principales acontecimientos en estas primeras etapas. Los ribosomas extraídos de las semillas imbibidas son muy activos en la síntesis de polipéptidos. La síntesis de protoplasma y de nuevas paredes celulares forma parte de este crecimiento del eje embrionario. Requiere de una respiración activa en la cual se utilizan las reservas de carbohidratos, lípidos y proteínas que estaban almacenados. Generalmente el eje embrionario tiene suficientes reservas para satisfacer sus necesidades inmediatas, pero pronto es necesario usar las reservas almacenadas en el endospermo. En el siguiente ejemplo se analiza lo que sucede en la semilla de la cebada (Figura IV.4). En esta semilla, el embrión se encuentra en un extremo y el resto de la semilla está formada por el endospermo que son células muertas llenas de granos de almidón y de algunas proteínas. Poco tiempo después de que el embrión ha iniciado la germinación, el endospermo se empieza a disolver. Las paredes celulares se degradan, las reservas en forma de proteínas se hidrolizan para formar aminoácidos y el almidón también se hidroliza para formar azúcares reducidos, los cuales se convierten en sucrosa para ser transportados al embrión. Todo este proceso se lleva a cabo mediante las enzimas secretadas por la capa de aleurona que rodea al endospermo. Las enzimas son a amilasa, proteasa, ribonucleasa y b1,3- glucanasa, que ataca la hemicelulosa de las paredes. Todas ellas son secretadas hacia el endospermo y en sólo 3 o 4 días lo licuan totalmente.
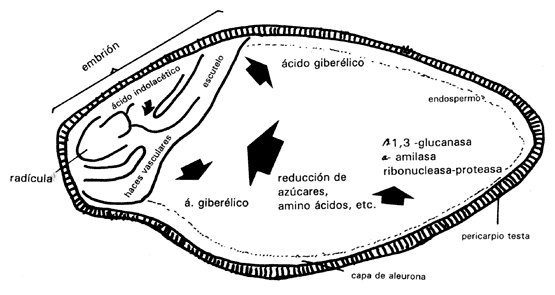
Figura IV.4. Diagrama del corte longitudinal de un grano de cebada que muestra la actividad que se desarrolla en diferentes regiones de la semilla con respecto a las hormonas, enzimas y algunos de los productos de la acción de las enzimas (Black, 1972). Véase texto para mayor explicación.
Este proceso es controlado por el embrión, que usa ácido giberélico, el cual fue previamente sintetizado por el eje embrionario, para mandar señales a la capa de aleurona. Veinticuatro horas después, el escutelo (proyección del eje embrionario en las gramíneas) también empieza a sintetizarlo. En experimentos hechos con semillas a las que se les ha quitado el embrión, no se desencadena este proceso, pero si a estas semillas se agrega un poco de ácido giberélico diluido, la capa de aleuronas empieza a secretar enzimas.
El coleoptilo del embrión en crecimiento comienza a sintetizar ácido indolacético, hormona que tiene como función iniciar la diferenciación del tejido vascular. Justamente a través de este tejido vascular se transporta el ácido giberélico hacia la capa de aleurona. Por lo tanto, son dos las hormonas que intervienen en el control de la movilización de reservas en el endospermo: el ácido giberélico para la producción de enzimas y el ácido indolacético para ayudar al transporte del ácido giberélico.
Las enzimas son sintetizadas por la propia capa de aleuronas en respuesta al ácido giberélico, excepto la b1,3- glucanasa, aunque aún no se conoce el proceso con detalle. En la figura IV.4 aparece una síntesis de algunas de las actividades metabólicas que tienen lugar durante la germinación de la cebada. Los factores que controlan la movilización de reservas en otras semillas que no sean cereales, son menos conocidas.
La entrada de agua a la semilla, el incremento en la respiración y los cambios bioquímicos descritos culminan primero en la germinación y por tanto en el crecimiento del embrión y posteriormente en el desarrollo y crecimiento de la plántula.
Por lo general el primer signo de la germinación es la aparición de la radícula, pero en algunas semillas, como el haba ( Vicia faba), se da un crecimiento apreciable antes de que la testa se rompa. En algunas especies el crecimiento del hipocótilo es la primera manifestación visible de la germinación. Este patrón se encuentra en familias como las bromelias, palmas, chenopodiáceas, onagráceas, saxifragáceas y tifáceas.
El destino del cotiledón es otro rasgo que distingue a las semillas germinadas de diferentes especies. Desde esta perspectiva es posible dividir a las plántulas en dos grupos:
i) Epigeas, en las cuales los cotiledones se levantan fuera del suelo y generalmente se vuelven verdes y fotosintéticos (Figura IV.5(a)).
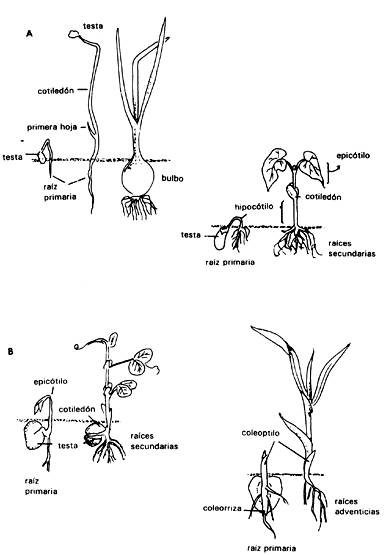
Figura IV.5. A) Ejemplos de plántulas con germinación epígea: el primer esquema muestra la cebolla,Allium cepa y al frijol, Phaseolus vulgaris. Se muestran los diferentes estadios desde semilla hasta plántula. B) Algunos ejemplos de plántulas con germinación hipogea: Pisum sativum (chícharo) yZea mays (maíz).
Dentro de las dicotiledóneas, esta diferencia es clara en función de los distintos grados de crecimiento o extensión del hipocótilo. En el primer caso el hipocótilo crece bastante, levantando los cotiledones, y en el segundo caso permanece pequeño. Posteriormente, cuando los cotiledones se separan, el epicótilo se elonga para que las dos primeras hojas queden al aire y reciban la luz del Sol. En general, se acepta que el escutelo de las gramíneas constituye un cotiledón modificado (al igual que el haustorio de otras monocotiledóneas). Ninguno de éstos se eleva por encima del endospermo durante la emergencia de la plántula.
Se presentan tanto en semillas endospérmicas como en las no endospérmicas, aunque la germinación hipogea de semillas endospérmicas en dicotiledóneas es más bien rara. A continuación se listan algunos ejemplos:
| Hipogea - endospérmica: | Triticum aestivum (trigo) | |
| Zea mays (maíz) | ||
| Hordeum vulgare (cebada) | ||
| Phoenix dactylifera (palma dátil) | ||
| Hevea spp. (hule) | ||
| Hipogea - no endospérmica: | Pisum sativum (chícharo) | |
| Vicia faba (haba) | ||
| Phaseolus multiflorus(frijol) | ||
| Aponogeton spp. | ||
| Epigea - endospérmica: | Ricinus communis (ricino) | |
| Fagopyrum esculentum | ||
| Rumex spp. | ||
| Allium cepa (cebolla) | ||
| Epigea - no endospérmica: | Phaseolus vulgaris (frijol) | |
| Cucumis sativus (pepino) | ||
| Cucurbita pepo (calabaza) | ||
| Sinapis alba (mostaza) | ||
| Arachis hypogaea(cacahuate) | ||
| Lactuca sativa (lechuga) | ||
Los cotiledones de las semillas no endospérmicas generalmente almacenan las reservas que se usan durante las primeras etapas de crecimiento de las plántulas. Por otro lado, en las semillas endospérmicas las reservas están precisamente en el endospermo y los cotiledones desempeñan un papel importante en la movilización de las reservas pues absorben los carbohidratos, lípidos y proteínas digeridos. Ejemplos de ello son las semillas de Ricinus communis (ricino) y de Allium cepa (cebolla). En las monocotiledóneas el cotiledón se ha especializado en la absorción de reservas. En Tradescantia, la punta de dicho cotiledón se mantiene dentro del endospermo y está unido a la base del coleoptilo. En Cocos nucifera (coco) el cotiledón se agranda e invade el endospermo y, en las gramíneas, el escutelo absorbe los productos del endospermo disuelto y los transfiere al eje embrionario.
Esta etapa de la vida de la planta es una de las más vulnerables. De ahí el esfuerzo de la planta progenitora para que existan suficientes reservas que ayuden en el inicio, en lo que la planta se desarrolla lo suficiente como para competir con otras y obtener agua y sustancias nutritivas.
Investigaciones hechas en distintas partes del mundo en las que se ha estudiado el destino de las semillas y plántulas producidas por un individuo han demostrado que el número de semillas germinadas es frecuentemente alto. Sin embargo, el número de plántulas que logran establecerse, llegar finalmente al estado adulto y reproducirse es muy bajo. En la siguiente lista aparecen datos sobre la mortalidad de plántulas durante la primera fase de establecimiento:
Forma de | ||||
Especie | Mortalidad | Tiempo | crecimiento | |
| Alyssum alyssoides | 1 000-700 | 4-5 semanas | hierba | |
| Sedum smalli | 250-40 | 4-5 semanas | hierba | |
| Pastinaca sativa | 1 000-90 | 1 año | hierba | |
| Melilotus alba | 100-4 | 1 año | hierba | |
| Chamaecrista chamaetoides | 2 000-500 | 3 meses | arbusto | |
| Artemisia tripartita | 40-6 | 5 años | arbusto | |
| Acacia burkittii | 20-8 | 5 años | arbusto | |
| Acer saccharum | 100-1 | 2 años | árbol | |
| Pinus silvestris | 10 000-1 | 2 años | árbol | |
Durante esta etapa del ciclo de vida el medio ambiente constituye un lugar muy riesgoso donde pocos individuos pueden establecerse y sobrevivir. Sin embargo, para reemplazar a la planta que dio origen a esas semillas y a esas nuevas plántulas sólo hace falta que una sobreviva. En el caso de las plantas anuales (las dos primeras de la lista) es fundamental que sobreviva cada año un número tal que garantice que la población va a permanecer. Para estas especies, cada año hay un momento en que sólo están representadas en el ambiente por sus semillas, pues la plántula ya fructificó, sus semillas se dispersaron, se completó el ciclo y murió. De la germinación y establecimiento de esas semillas y plántulas depende que la especie permanezca en la zona. En el caso de las perennes la producción de semillas es anual; por ello la planta cuenta con más tiempo para producir individuos que la reemplacen. Sin embargo, cada año se enfrenta a los mismos riesgos de las semillas y plántulas que tienen ciclos anuales.

No hay comentarios:
Publicar un comentario